医药数读
这类疾病逾90%无药可医,弥合巨大落差应从何处着手?
2022-12-13 14:21:21 来源:丁香园
罕见病,这类一度曾被忽视的疾病最近赢得了越来越多的关注。市场需求的刺激与政策法规的推动,罕见病药物从研发到供应保障都取得长足的进步。不过,纵使如此,药物供给与临床需求依然面临不小的落差。在总数超过 7000 种罕见病中,有治疗方案的不到 10%。在新版国家医保药品目录中已有 45 种罕见病用药被纳入,但仅覆盖了 26 种罕见病。
这一落差不仅意味着巨大的未满足的临床需求,也代表着巨大的市场机会。在该领域,北海康成已经深耕 10 年之久,取得了诸多亮眼成绩,而且其研发管线已经拓展至罕见肿瘤,并在基因治疗领域进行了前瞻布局。
丁香园 Insight 数据库 BU Head 王辉先生与北海康成药政事务高级副总裁张苒女士就相关话题展开分享。

王辉先生:北海康成是第一家全方位布局罕见病中国创新药企业。在公司创立之初,罕见病并未取得像今天这样的关注度,疾病名录也未出台。请问公司选择这一领域作为发展方向的初衷是什么?
张苒女士:这一话题要从北海康成 CEO 薛群博士的经历说起。上世纪 90 年代,薛群博士赴美留学,先后在美国布朗大学取得生物有机化学博士、在弗吉尼亚达顿商学院获得工商管理硕士,而后加入到全球知名的罕见病药公司健赞。在时任健赞 CEO 亨利·特米尔的指导下,薛群博士对罕见病药物的认识愈加深刻。2008 年,薛群博士受健赞委派回到中国开展业务,在此期间,他将数款重磅罕见病药物引入到中国,极大缓解了中国患者的治疗需求。2012 年,在亨利·特米尔的鼓励下,薛群博士先后两次回国创业,最终创立了立足于中国的罕见病药物公司北海康成,希望为众多的患者研发出可以负担得起的新药。在北海康成创办以来的 10 年里,公司始终聚焦于罕见病,并在 2021 年在香港交易所上市。
我们欣喜地看到,罕见病越来越受到世人的关注,国家陆续推出了许多利于罕见病药物研发上市的政策措施,罕见病的科普及患者教育资源也丰富了很多。
今年 10 月底召开的第四届中国罕见病大会, 全国政协副主席、农工党中央常务副主席何维,工信部、医保局和药监局的主要领导都纷纷出席并发表致辞,显示出国家层面领导对于罕见病治疗和新药开发的重视。可以预见,罕见病患者的未来一定会越来越光明,北海康成也一定会在这一赛道上持续深耕,全力造福广大患者。
王辉先生:罕见病种类繁多,北海康成研发管线重点关注哪些罕见病药物的开发?此外,罕见病发病机制复杂,治疗原理各异,在开展药物研发时,公司的研发策略是什么?
张苒女士:北海康成在制定研发策略时,基本出发点在于患者的需求。我们首先会审视一种罕见病是否已有成熟的治疗手段,如果缺乏有效的治疗手段,面临巨大的未满足需求,那么这种疾病的治疗药物便会被列入候选。
其次,将哪一种药物列入研发管线,公司倾向于合作引入和开发自身较为擅长的方向。例如北海康成在溶酶体贮积症药物的开发方面,拥有丰富的经验。这类疾病是由于基因突变致溶酶体中有关酸性水解酶缺陷,导致患者体内相应的生物大分子不能正常降解而在溶酶体中贮积,引起细胞组织器官功能的障碍,可以累及身体多个器官,并产生一系列有可能威胁生命的症状。我们熟悉这一类产品的药学、非临床和临床开发路径,有利于快速将这类产品推向市场,为尽早服务患者提供保障。
第三,由于大部分罕见病都属于遗传病,根源涉及到基因的改变。比如刚刚提到的溶酶体贮积症药物,患者服用后,可以拥有较好的生活质量,但患者需要终身用药。想要从根本上解决问题,可能需要基因治疗的手段。北海康成在进行管线决策时,基因治疗药物是重要的攻坚方向。
目前为止,公司研发管线上已有十余款产品,以研发周期来划分,分为短期和长期两种。前者针对国外已处于研发后期,国内存在治疗空白的品种,通过 License-in 的方式引入到国内,缩短上市周期,及早服务于患者。后者从立足中国,放眼全球的角度,主要包括一些自主开发以及与合作伙伴一同开发的产品。
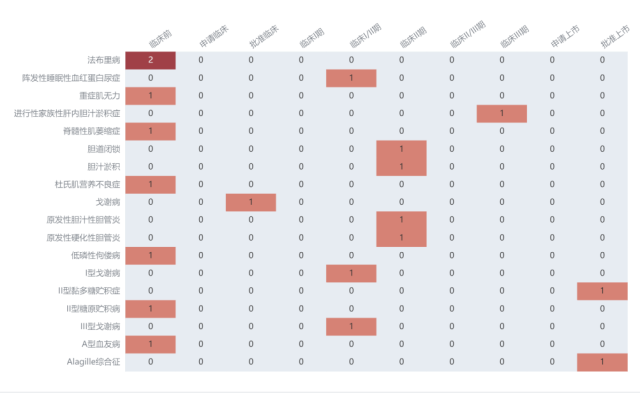
北海康成在罕见病领域全球新药项目总览,数据截图:Insight数据库
王辉先生:中国庞大的人口基数令许多罕见病并不「罕见」,因此中国罕见病市场被视为全球最大的单一市场,但目前药物可及性和支付问题仍然存在,相关法律法规和激励措施亦有待跟进。您如何看待中国罕见病市场的未来?
张苒女士:2015 年以来,国家药监局对创新药审评审批制度进行了改革,出台了一系列鼓励创新和加快新药上市的重磅政策,这对包括罕见病药物在内的创新药研发行业起到了巨大的推动作用。
2019 年,国家卫健委遴选罕见病诊疗能力较强、诊疗病例较多的 324 家医院组建了全国罕见病诊疗协作网,对罕见病患者进行相对集中诊疗和双向转诊,以充分发挥优质医疗资源辐射带动作用,提高我国罕见病综合诊疗能力。经过各方努力,2018 年,国家卫健委等五部门联合印发了《第一批罕见病目录》,纳入了 121 种罕见病。希望不久后,更新版《目录》也会出台。
不仅如此,药审中心还相继颁布了《罕见疾病药物临床研发技术指导原则》、《罕见疾病药物临床研究统计学指导原则》,以及一系列罕见病的临床试验技术指导原则。这些文件对罕见病药物的临床开发起到了很好的指导作用。
另外,药监局药审中心在将罕见病药物纳入快速通道、附条件批准、突破性治疗资格、优先审评审批时,政策取向上采取了倾斜态度。这对于药物的开发上市,起到了不同程度的加速作用。包括最近发布的《药品管理法实施条例》征求意见稿中首次明确提到,罕见病药物最长可以拥有7年独占期,这对企业也是一个非常大的鼓励。
总之个人认为,在新产品的开发方面,药监局和药审中心建立了多种交流沟通程序,使得企业有更多机会与药监局 CDE 进行交流沟通。当我们遇到一些困难或困惑时,监管部门愿意给予企业指导,双方有很多沟通的途径。可以预见,在政企双方的携手努力下,势必会有越来越多的罕见病药物问世,患者的治疗需求也将得到极大的缓解。
王辉先生:北海康成部分产品是通过 License-in 的方式引入到中国,这种模式非常考验公司眼光和商业化能力,请您介绍一下公司管理团队在这方面的积累?
张苒女士:如前所述,在选择产品时,临床需求是重要的衡量标准,尤其是对于缺乏有效治疗手段/有着急迫需求的疾病,希望看到药物在国内快速落地,我们通常会借助 License-in 的方式将药物引入到中国。
在这方面,北海康成以 CEO 薛群博士为代表的的管理团队有着丰富的罕见病药物开发与商业化经验,公司还拥有一个由国内外相关专业领域顶级专家组成的智囊团,他们的建议也会提高公司决策的胜算。
目前,在罕见病新药开发的赛道上,北海康成已有 3 款产品通过 License-in 的方式落地于中国大陆、台湾和香港,适应症包括亨特氏综合征及肿瘤等。公司目前还有一款治疗阿拉杰里综合征(ALGS)的药物,2021 年 9 月在美国获批,目前已获得中国药监局优先审评资格。这款产品的上市主要基于海外患者的数据,从签署协议到 NDA 申报,只耗时短短 7 个月时间,周期大大缩短。
王辉先生:据悉,除了罕见病外,北海康成在肿瘤领域也有布局,请您介绍相关药物所针对的适应证、作用机制以及研发进度情况?
张苒女士:在肿瘤领域,我们更加聚焦于罕见肿瘤,其中商业化进度最快的产品用于治疗脑胶质母细胞瘤(GBM)。这款产品引进自德国,进入中国后,我们已经完成了本地化转移和药学开发,正在使用中国生产的产品在进行 2 期临床。
王辉先生:众所周知,原创药物研发通常周期长、耗资大、风险高,即便如此,北海康成仍然不畏风险、坚持走自主研发原创药物的路线,并取得了令人瞩目的成绩。能否介绍下北海康成如此坚持的原因,以及成功的经验有哪些?
张苒女士:这个问题可能更加适合我们 CEO 来回复,这里我仅分享一下我个人的体会。首先,如前所述,罕见疾病药物开发的挑战和困难,已经逐渐被政府部门关注,国家药监部门在政策层面,给与罕见病药物开发许多鼓励和优惠条件,沟通渠道也相对顺畅。这意味着北海康成从事的研发方向是受到国家政策鼓励和大力支持的。
其次,大部分罕见病都缺乏合适的药物,当我们清楚了解到一个候选药物的作用机理,前期试验显示它有可能改善患者病情和生活质量时,那么争取快速拿到临床数据,将其尽快推向市场,进而造福患者。
第三,罕见病药物的研发不但受到国家的大力支持,我们也看到业内很多制药巨头也十分关注这一领域,例如,阿斯利康在 2020 年底就曾斥资 390 亿美元收购亚力兄制药。因此,坚持走自主研发原创药物固然风险大,但如果这条路能够走通,有助于吸引更多投资,帮助我们开发更多更好的产品。
王辉先生:当前创新药行业融资遇冷,一二级市场倒挂并不鲜见,这对创新药公司的现金流提出极大挑战,北海康成是如何应对这一挑战的?
张苒女士:目前创新药行业的融资环境的确遭遇「寒流」,市场上追求快速回报的资金正在离开,但坚持到最后的投资人是深刻了解这一行业的。北海康成在去年上市之前,已经完成了 4 轮融资,资金面比较健康,因此具备一定抵御风险的能力。
最为关键的是,公司拥有稳固的研发管线,加之我们非常注重将资金花在「刀刃」上。 我们会着力加强临床试验阶段的项目,持续地向外界展示公司的新药发现、研发和临床转化能力,既有利于赢得医疗领域长期资金的持续关注,也有利于及早实现公司现金流的正向循环。
结 语
十年磨一剑,已经成立十年的北海康成秉持患者至上,创业精神,合作共赢,勇于创新,正直诚信的崇高使命,聚焦于罕见病与罕见肿瘤,不仅研发生物制剂和小分子药物,而且还前瞻性地投资于下一代基因治疗技术。
张苒表示,近年来我国新药的审评审批机制正在快速进步,监管体系也愈加完善,正在向世界先进水平靠拢。身为医药行业从业人士,也应当与时俱进,借助各类数据库工具及时了解新药政策的最新变化和竞品的研发申报进度。这一点丁香园 Insight 数据库能够很好地满足需求,新近上线的全球新药模块囊括了全球超 4 万个新药及改良新药项目,将临床前到获批上市全流程打通,而且每日持续更新,并提供强大准确的溯源能力。
她期待,双方后续可做进一步的常态化沟通,一方面可及时了解 Insight 数据库提供的新功能和新工具,提升决策的精准度,另一方面也能对数据库的使用和功能提出反馈,共同提升药学数据产品的质量。
张 苒
北海康成 药政事务高级副总裁
张苒女士在肿瘤及免疫治疗领域有着十分丰富的药政法规事务经验。在加入北海康成前,她曾在天境生物担任药政法规事务负责人,专注于肿瘤、免疫学等治疗领域的药政法规事务工作。在此期间,她带领团队在任职期间,带领团队获得多个新药 IND 批件(包括 NMPA 和 FDA)。
张苒女士在药政法规事务方面拥有超过 20 年的经验,曾任职于多家跨国企业包括葛兰素史克、赛诺菲、阿斯利康、强生等公司,她曾带领大型注册团队为强生中国区业务提供药政事务支持。在加盟制药企业之前,张苒女士担任中日友好医院针灸科医生。
本网站所有注明“来源:丁香园”的文字、图片和音视频资料,版权均属于丁香园所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:丁香园”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。

网友评论
dxy_j8m9ivf
'"click_me#
顶(0) | 踩(0) | 回复 发表于2025-08-22 01:03:44
dxy_yh0wag09
alert(test!)
顶(0) | 踩(0) | 回复 发表于2024-05-15 23:01:35
dxy_4g7z1agr
111
顶(0) | 踩(0) | 回复 发表于2023-01-10 21:25:08